Subtotal: 0 ₫
Tin tức, Kiến thức Clo
Axit clohydric HCl là gì? Tính chất, cách điều chế và ứng dụng
HCl là hợp chất được ứng dụng phổ biến trong nhiều lĩnh vực, đặc biệt là công nghiệp sản xuất thép, xử lý nước, sản xuất các hợp chất vô cơ… Vậy HCl là gì? Tính chất, cách điều chế và ứng dụng ra sao? Khi sử dụng cần lưu ý điều gì? Hãy cùng LifeVista tìm hiểu chi tiết về hóa chất này trong bài viết dưới đây bạn nhé!
1. Axit clohydric HCl là gì?
Axit clohydric là một loại axit mạnh, được tạo ra từ sự hòa tan khí hydro chloride (HCl) trong nước. Ở nhiệt độ thường, dung dịch axit HCl là chất lỏng không màu, trong suốt hoặc có màu vàng nhạt khi lẫn tạp chất.
Dung dịch HCl đậm đặc nồng độ tối đa là 40%, có khả năng ăn mòn các mô con người, làm tổn thương cơ quan hô hấp, da và ruột. Axit clohydric được pha loãng để làm chất vệ sinh, lau chùi nhà cửa, sản xuất gelatin, chất tẩy rửa và các phụ gia thực phẩm.
Thông thường, Acid hydrochloric được sản xuất với nồng độ tối đa 38%, ở nồng độ cao hơn 40% chúng bay hơi nhanh khó khăn trong việc bảo quản. HCl công nghiệp thường có nồng độ 30 – 34%, ở nồng độ này dễ vận chuyển và giảm thất thoát khi bảo quản.
Đây là một trong những hóa chất quan trọng hàng đầu, được sử dụng nhiều trong các ngành sản xuất, chế biến thực phẩm và làm sạch. Tuy nhiên trong quá trình sử dụng phải cẩn thận vì axit HCl có tính ăn mòn mạnh, có thể làm tổn thương đến các cơ quan của cơ thể.
HCl được tìm thấy trong dịch vị dạ dày, đóng vai trò quan trọng trong hệ tiêu hóa của con người và các loài động vật.
Một số tên gọi khác của Axit clohydric là: Axit hidrocloric, Axit muriatic, Cloran, Hydrochloric acid, Acid hydrochloric…
2. Tính chất của HCl
2.1. Tính chất vật lý của axit clohydric
- Công thức hóa học: HCl
- Trạng thái tồn tại: Ở dạng khí, HCl không màu, mùi sốc, nặng hơn không khí. HCl tan nhiều trong nước tạo thành axit mạnh; ở dạng lỏng, dung dịch HCl acid loãng không màu, dễ bay hơi. Tuy nhiên HCl đậm đặc 40% có màu vàng ngả xanh lá.
- Độ hòa tan trong nước: 725g/l ở 20 độ C
- Trọng lượng mol: 36,5 g/mol
- Độ nhớt (mPa·s): 1,80
- Áp suất hơi (Pa): 3,73
- Điểm sôi (°C): 84
- Điểm nóng chảy (°C): -43
2.2. Tính chất hóa học của HCl
Axit HCl là một axit mạnh, làm đổi màu quỳ tím thành đỏ. Những chất tác dụng được với HCl là: Kim loại trước Hidro trong dãy điện hóa (trừ Pb), Oxit kim loại, bazo, muối và chất oxy hóa mạnh.
Tính chất hóa học của HCl cụ thể như sau:
- HCl tác dụng với các kim loại đứng trước nguyên tố H tạo thành muối và khí hidro (trừ Pb). Ví dụ phương trình hóa học:
Fe + 2HCl → FeCl2 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
- Axit clohydric có tính oxy hóa tác dụng với oxit kim loại, tạo thành muối clorua và nước:
CuO + 2HCl → CuCl2 + H2O
- HCl tác dụng với bazơ tạo thành muối clorua và nước:
2HCl + 2NaOH → 2NaCl + H2O
2HCl + Ca(OH)2 → CaCl2 + 2H2O
2HCl + Fe(OH)2 → FeCl2 + 2H2O
- Axit HCl tác dụng với muối có gốc anion hoạt động yếu hơn tạo thành muối mới và axit mới, sản phẩm có kết tủa hoặc chất khí bay lên:
AgNO3↓ + HCl → AgCl + HNO3
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl → NaCl + H2O + CO2↑
- Axit clohydric HCl có tính khử, tác dụng với chất có tính oxy hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3:
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
Axit HCl không tác dụng với axit, phi kim, oxit phi kim, kim loại đứng sau Hidro trong dãy điện hóa (Cu, Ag, Au,…), các muối không tan (muối có gốc CO3 và PO4, trừ K2CO3 và Na2CO3,K3PO4 và Na3PO4)
3. Cách điều chế và sản xuất axit clohydric HCl
3.1. Điều chế HCl trong phòng thí nghiệm
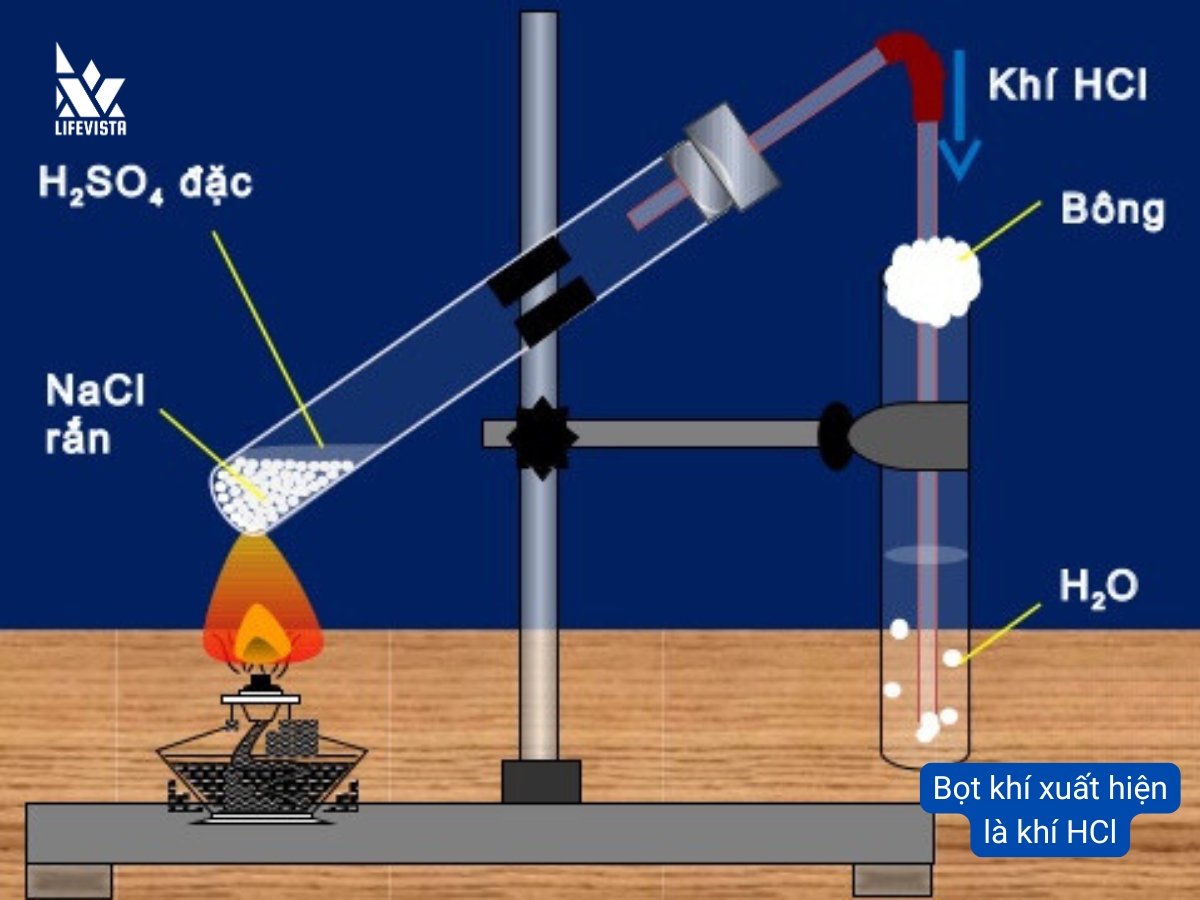
Trong phòng thí nghiệm HCl được điều chế bằng phương pháp sunfat, cho tinh thể NaCl phản ứng với axit sunfuric H2SO4 đậm đặc ở nhiệt độ cao. Phương pháp này có thể tạo ra axit HCl đậm đặc 40%.
Phương trình điều chế axit HCl trong phòng thí nghiệm:
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl (< 250 độ C)
2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl (> 400 độ C)
Khí HCl sinh ra sau phản ứng sẽ dẫn qua nước để tạo thành dung dịch axit HCl. Axit clohydric điều chế bằng phương pháp sunfat có độ tinh khiết cao. Tuy nhiên không được ứng dụng để sản xuất thương mại vì giá thành của axit H2SO4 cao hơn axit HCl.
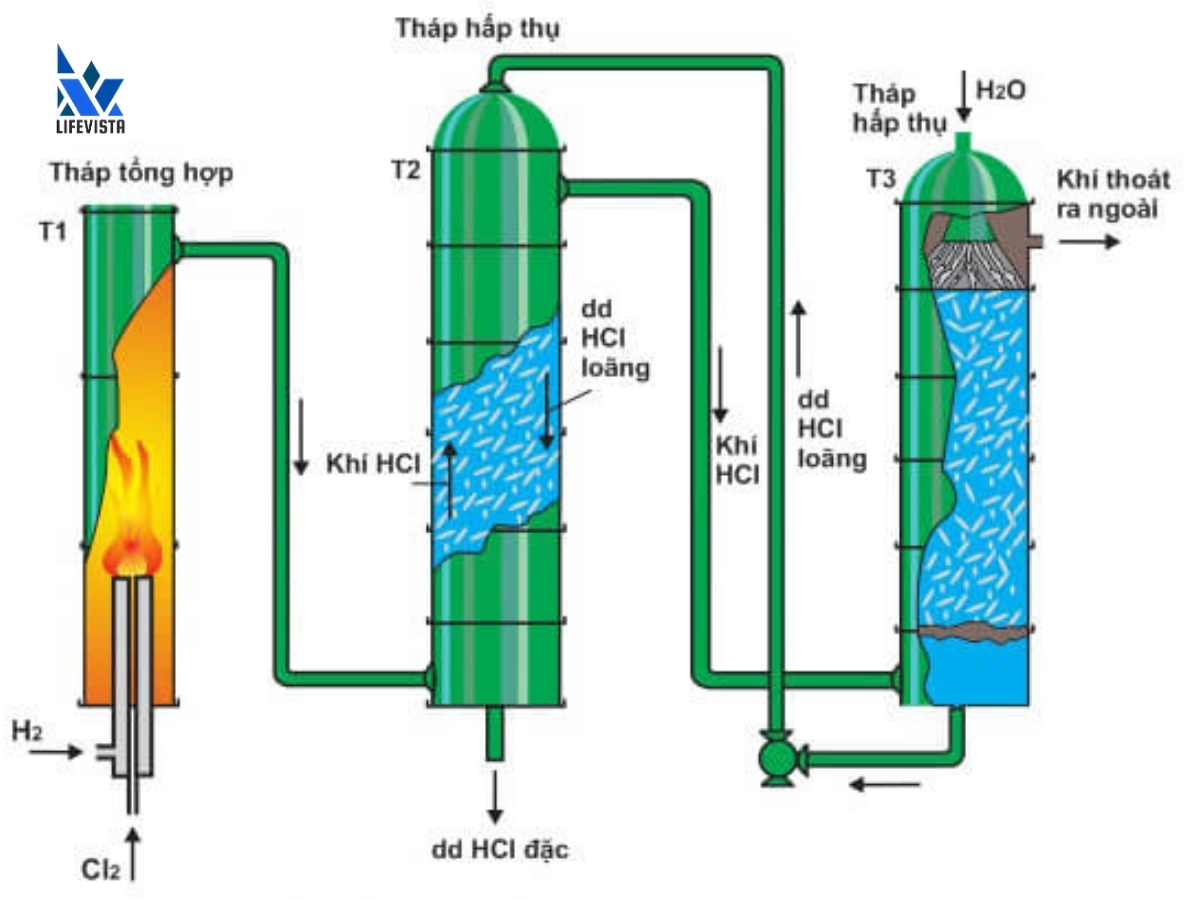
3.2. Điều chế axit HCl trong công nghiệp
Trong công nghiệp, HCl được điều chế trực tiếp từ khí Clo và khí Hidro. Để đảm bảo phản ứng diễn ra hoàn toàn, lượng khí Hidro phải cao hơn khí Clo 1 – 2%. Khí HCl được tạo thành có độ tinh khiết cao, sau khi hòa tan vào nước sẽ tạo thành dung dịch axit HCl.
Phương trình điều chế HCl trong công nghiệp như sau:
H2 + Cl2 → 2HCl
Khí hidro và clo được sản bằng phương pháp điện phân dung dịch NaCl (muối ăn) có màng ngăn. Phương pháp này mang lại năng suất cao, chi phí thấp, đáp ứng được nhu cầu sản xuất công nghiệp.
Ngoài ra, HCl cũng được tổng hợp từ một số phương pháp khác:
- Nhiệt phân 1,2 – dicloretan thành vinyl clorua (Có đến 90% lượng HCl ở Mỹ được sản xuất theo phương pháp này). Phương trình phản ứng:
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
- Hydrat hóa clorua kim loại nặng:
2FeCl3 + 6H2O → Fe2O3 + 3H2O + 6HCl
- Clorua hóa ankan RH (R là gốc hydrocacbon)
Cl2 + RH → RCl + HCl
4. Ứng dụng của HCl
HCl là axit mạnh và có tính ứng dụng cao trong nhiều lĩnh vực đời sống và sản xuất. Vậy HCl dùng để làm gì? Dưới đây là một số ứng dụng điển hình nhất của axit clohydric là:
4.1. Trung hòa pH xử lý nước hồ bơi
Axit HCl là một loại hóa chất hỗ trợ giảm pH hồ bơi phổ biến. Khi nồng độ pH trong nước hồ bơi quá cao, vượt mức an toàn 7.2 – 7.6, sử dụng HCl giảm pH rất hiệu quả.
Đối với xử lý nước hồ bơi, axit HCl 32% là vừa đủ, dễ vận chuyển và bảo quản cũng như sử dụng. Nếu dùng axit đậm đặc hơn sẽ rất dễ bay hơi, khó bảo quản và khá nguy hiểm.
Ngoài công dụng điều chỉnh pH, axit HCl 32% còn có tác dụng diệt khuẩn, tẩy sạch mảng bám, vết nhớt, chất gỉ bám ở thành và đáy bể. Giúp ngăn ngừa sự phát triển của rêu tảo và vi sinh vật, duy trì chất lượng nước hồ bơi.
Axit HCl cũng được sử dụng để điều chỉnh độ pH trong quá trình xử lý nước thải công nghiệp. Nước thải thường có tính kiềm cao, HCl được thêm vào để giảm độ kiềm, đưa pH về mức an toàn trước khi xả ra môi trường.
Việc trung hòa pH giúp ngăn ngừa ô nhiễm và bảo vệ hệ sinh thái nước ngọt, đồng thời đáp ứng các tiêu chuẩn về môi trường.
Xem thêm: Ứng dụng của HCl trong xử lý nước bể bơi | Giá bán axit HCl

4.2. Tẩy vết gỉ trên thép
HCl acid là hóa chất tẩy bẩn mạnh và có giá thành rẻ. Trong chế biến kim loại, hóa chất này được ứng dụng để loại bỏ gỉ trên bề mặt thép, trước khi sử dụng để cán hay mạ điện.
Phương trình hóa học mô tả quá trình tẩy gỉ thép như sau:
Fe2O3 + Fe + 6HCl → 3FeCl2 + 3H2O

4.3. Sản xuất các hợp chất hữu cơ
Axit HCl dùng làm nguyên liệu sản xuất vinyl clorua và dicloetan sản xuất PVC, bisphenol A sản xuất polycarbonate, than hoạt tính, và axit ascorbic,… và một số dược phẩm khác.
4.4. Sản xuất các hợp chất vô cơ
Axit HCl là một trong những nguyên liệu chính để sản xuất các loại muối clorua kim loại như kẽm clorua (ZnCl₂), canxi clorua (CaCl₂) và sắt clorua (FeCl₃). Những muối này được sử dụng rộng rãi trong nhiều ngành công nghiệp:
- Kẽm clorua: Là chất khử mùi trong công nghiệp nhuộm, chất bảo quản gỗ và thành phần quan trọng trong quá trình mạ điện.
- Canxi clorua: Dùng làm chất chống đóng băng trên đường vào mùa đông, ổn định và làm cứng trong xây dựng.
- Sắt clorua: Được ứng dụng phổ biến trong xử lý nước thải và sản xuất mực in.
Dung dịch HCl tạo ra các hợp chất này thông qua các phản ứng hóa học trực tiếp, giúp tối ưu hóa quy trình sản xuất với chi phí thấp và hiệu quả cao.
4.5. Axit HCl tái sinh chất trao đổi icon và ứng dụng trong hệ thống lọc nước
Trong hệ thống lọc nước bằng công nghệ trao đổi ion, các hạt nhựa trao đổi ion mất đi khả năng hoạt động khi bị bão hòa bởi các ion khác. Axit HCl được dùng để rửa sạch các cation khỏi nhựa trao đổi icon. Từ đó tái tạo lại hiệu suất hoạt động của các hạt nhựa, giúp hệ thống lọc duy trì chất lượng nước sạch lâu dài.
Quy trình này được áp dụng phổ biến trong các hệ thống lọc nước quy mô lớn, như nước uống, nước xử lý cho nhà máy và nước dùng trong các ngành công nghiệp.
4.6. Một số ứng dụng khác của axit clohydric HCl
Ngoài các ứng dụng phổ biến trên, HCl còn được ứng dụng trong nhiều ngành sản xuất như công nghiệp thực phẩm, sản xuất bột giấy, dược phẩm, nhựa, cao su,.. Cụ thể như sau:
- Ngành công nghiệp thực phẩm: Axit HCl được sử dụng để kiểm soát độ pH trong một số loại thực phẩm và đồ uống, đặc biệt là trong quá trình chế biến gelatin và chiết xuất protein.
- Chế biến bột giấy: HCl đóng vai trò quan trọng trong việc tẩy trắng giấy và bột giấy, làm cho sản phẩm đạt được độ sáng và độ trắng tối ưu.
- Các ngành sản xuất khác: HCl còn tham gia vào sản xuất dược phẩm, nhựa và cao su, giúp xử lý và tinh chế nguyên liệu thô trước khi tiến hành các công đoạn chế tạo phức tạp khác.

6. Lưu ý khi sử dụng và bảo quản HCl acid
Axit HCl có thể gây bỏng da, tổn thương mô, đặc biệt khi tiếp xúc với HCl đậm đặc nồng độ cao. Nếu hít phải khí HCl sẽ gây kích ứng đường hô hấp, dẫn đến ho, khó thở, nồng độ cao có thể gây bỏng đường hô hấp. Nếu bị dính axit vào mắt có thể gây mù lòa nếu không được điều trị kịp thời.
Do vậy trong quá trình sử dụng axit Axit clohydric HCl cần phải lưu ý những điều sau:
- Luôn đeo găng tay, kính bảo hộ và mặt nạ khi làm việc với HCl. Bảo vệ mắt và da khỏi tiếp xúc trực tiếp với axit.
- Đảm bảo khu vực làm việc thông thoáng, có hệ thống thông gió để giảm thiểu nồng độ hơi HCl trong không khí.
- Lưu trữ dung dịch HCl trong các bình chứa chuyên dụng, được làm từ vật liệu chống ăn mòn, tránh xa nguồn nhiệt, ánh sáng mặt trời và nơi ẩm ướt.
- Không đổ HCl vào cống rãnh hay môi trường tự nhiên. Tuân thủ các quy định về xử lý hóa chất nguy hiểm để tránh ô nhiễm.
- Tránh để HCl acid tiếp xúc với các chất khác, đặc biệt là các chất kiềm, vì chúng có thể gây ra phản ứng mạnh và phóng thích khí độc.
- Nếu axit HCl dính vào da hoặc mắt, cần rửa ngay bằng nước sạch trong ít nhất 15 phút và tìm kiếm sự trợ giúp y tế.
6. Giá axit HCl công nghiệp là bao nhiêu?
Giá bán axit HCl tại giao động khoảng 5.000đ – 11.000đ/lí, mức giá này thay đổi tùy theo số lượng và nhà cung cấp. Ngoài ra, giá HCl bán lẻ, bán sỉ còn phụ thuộc nhiều vào các yếu tố như vận chuyển, thuế VAT, cung cầu thị trường, thời điểm mua hàng…
Để biết giá axit HCl chính xác, bạn hãy liên hệ với đơn vị chuyên cung cấp hóa chất để được tư vấn thêm.
7. Mua axit clohydric HCl công nghiệp ở đâu?
HCl (Axit clohydric) là một hóa chất phổ biến, có nhiều ứng dụng trong đời sống và sản xuất. Hiện nay có rất nhiều đơn vị phân phối hóa chất HCl trên thị trường. Để mua hóa chất HCl 31 – 32% giá tốt chất lượng cao, bạn hãy liên hệ với LifeVista.
Công ty TNHH Thương Mại LifeVista là đơn vị chuyên bán sỉ, bán lẻ hóa chất HCl 32% giá cạnh tranh, giao hàng toàn quốc và hỗ trợ thêm phí vạn chuyển nếu mua với số lượng lớn.

Tại LifeVista còn phân phối nhiều loại hóa chất hồ bơi, hóa chất nông lâm thủy sản và các thiết bị phụ kiện hồ bơi. Khi mua hàng tại LifeVista bạn sẽ được tư vấn cách sử dụng chi tiết nhất. Liên hệ với LifeVista qua hotline hoặc zalo OA để xem giá bán axit HCl bạn nhé!
8. Câu hỏi thường gặp về axit clohydric HCl
8.1 Axit clohydric có giống với HCl không?
HCl là công thức hóa học của cả hydro clorua và axit clohydric. Hydro clorua là khí, còn axit clohydric là dung dịch nước. Khi hòa tan Hydro clorua (HCl) trong nước sẽ tạo thành axit clohydric.
8.2 Axit clohydric có an toàn cho con người không?
Axit clohydric (HCl) có thể gây bỏng da và mắt, nếu nuốt phải HCl có thể gây tổn thương nghiêm trọng đến miệng, cổ họng và niêm mạc dạ dày. Hít phải khói HCl có thể dẫn đến các vấn đề về hô hấp, bao gồm kích ứng đường hô hấp và có khả năng gây tổn thương phổi.
8.3 Nồng độ HCl công nghiệp là bao nhiêu?
Acid hydrochloric trong công nghiệp thường sử dụng loại 30% – 34%. Ở nồng độ này dung dịch HCl dễ vận chuyển và dễ bảo quản, nồng độ cao hơn HCl bốc hơi nhanh, thất thoát nhiều.
8.4 Hít phải khí HCl có nguy hiểm không?
Hít phải khói HCl có thể làm kích ứng đường hô hấp, có khả năng gây tổn thương phổi. Nếu tiếp xúc trong thời gian dài sẽ dẫn đến viêm phổi, tổn thương phổi cấp tính.
8.5 HCl có độc hại không?
Axit Clohydric HCl đậm đặc có thể ăn mòn các bộ phân cơ thể, có thể gây tử vong. Hít phải hydro clorua có thể dẫn đến phù phổi. Nuốt phải có thể gây tổn thương nghiêm trọng cho miệng, cổ họng, thực quản và dạ dày. (1)
9. Kết luận
Trên đây là tất tần tật những thông tin liên quan đến HCl và Axit clohydric, hy vọng qua bài viết này bạn sẽ biết được HCl là gì, tính chất hóa học, cách điều chế và những ứng dụng quan trọng của axit clohydric HCl. Để tìm hiểu thêm các thông tin thú vị khác, bạn hãy truy cập website LifeVista nhé!
 Nối tứ thông dây tưới nhỏ giọt Rainbird
Nối tứ thông dây tưới nhỏ giọt Rainbird 


