Kiến thức Soda, Kiến thức hóa chất, Tin tức
NaHCO3 có lưỡng tính không? Tính chất hóa học của soda
NaHCO3 (Natri bicarbonate) hay baking soda là một hợp chất được sử dụng nhiều trong đời sống và sản xuất. Rất nhiều người quan tâm tìm đến tính chất hóa học của baking soda và thắc mắc “NaHCO3 có lưỡng tính không?”. Trong bài viết này, LifeVista sẽ đưa ra câu trả lời chi tiết, kèm theo đó là những minh chứng xác thực. Theo dõi ngay bạn nhé!
1. Trong hóa học, thế nào được gọi là hợp chất lưỡng tính?
Thuật ngữ lưỡng tính bắt nguồn từ tiếng Hy Lạp, có nghĩa là cả hai. Trong hóa học, hợp chất lưỡng tính là chất có thể đóng vai trò như một axit hoặc một bazơ (1). Tức là chúng có thể vừa cho proton, vừa nhận proton.
Một số ví dụ điển hình cho chất lưỡng tính là:
- Phân tử nước (H2O) có thể nhận thêm một proton, tạo thành ion H3O hoặc cho đi một proton để tạo thành ion OH-.
- Ion bicarbonate (HCO3-) cũng là một chất lưỡng tính vì nó có tính chất của cả axit và bazơ. Vậy NaHCO3 có lưỡng tính không? Xin mời bạn đọc tiếp nội dung dưới đây.
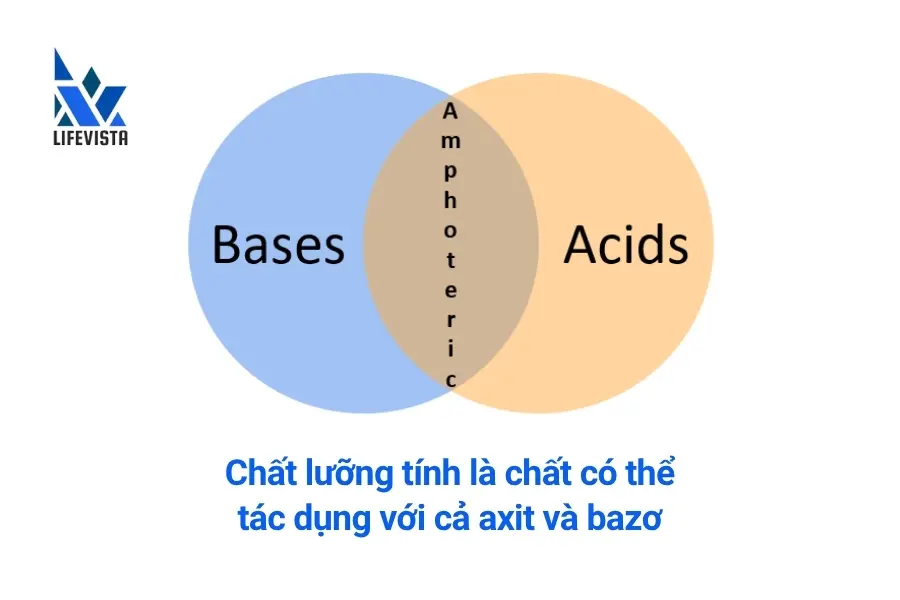
Lưu ý: Một số hợp chất có thể cho hoặc nhận proton là chất lưỡng tính. Nhưng không phải hợp chất lưỡng tính nào cũng có thể cho – nhận proton. Ví dụ như kẽm oxit (ZnO) là chất lưỡng tính nhưng nó không thể cho proton.
2. NaHCO3 là gì? Tổng quan về chất soda natri bicacbonat
Trước khi xác định được NaHCO3 có phải là chất lưỡng tính không, hãy cùng LifeVista tìm hiểu một vài thông tin về chất này.
NaHCO3 là công thức hóa học của Natri bicarbonat, tên gọi tiếng anh là sodium bicarbonate, tên thông dụng là baking soda hay soda. Đây là một chất rắn có màu trắng, tương tự như bột, có vị hơi mặn và ít tan trong nước. Độ hòa tan của baking soda chỉ khoảng 7.8g/100ml nước ở nhiệt độ 18 độ C.
NaHCO3 không bền với nhiệt. Khi đun nóng lên đến 50 độ C, NaHCO3 bắt đầu phân hủy tạo thành Na2CO3 (soda ash light, soda ash), nước và khí CO2. Quá trình chuyển đổi diễn ra nhanh hơn nếu nhiệt độ tăng lên đến 200 độ C.
Bột baking soda khô ráo có thể bảo quản lên đến 2 – 3 năm. Chất này có sẵn trong tự nhiên, được khai thác tư khoáng nahcolite và và quặng trona. Hai loại khoáng này thường được tìm thấy ở các hồ nước cạn.
3. NaHCO3 có lưỡng tính không?
Vậy NaHCO3 có phải chất lưỡng tính không? Câu cả lời là CÓ. NaHCO3 (Natri hiđrocacbonat hay baking soda) là một chất lưỡng tính vì nó vừa có thể tác dụng với kiềm, vừa tác dụng với axit.
Khi phản ứng với bazơ, NaHCO3 có thể cho proton (H+). Còn khi phản ứng với axit, nó có thể nhận proton. Theo thuyết Bronsted–Lowry, NaHCO3 vừa cho vừa nhận proton, do vậy đây là một hợp chất lưỡng tính.

4. Một số ví dụ chứng minh NaHCO3 là chất lưỡng tính
Thắc mắc NaHCO₃ có lưỡng tính không đã được giải đáp ở phần trên. Tuy nhiên, để hiểu rõ hơn tại sao NaHCO₃ lại có thể vừa mang tính axit, vừa mang tính bazơ, xin mời bạn đọc xem thêm hai phản ứng dưới đây:
5.1 NaHCO3 phản ứng với Axit
NaHCO3 có tính bazơ yếu, vì vậy khi tác dụng với các axit mạnh (HCl, H2SO4) sẽ tạo ra muối, nước và khí cacbonic (CO2). Nhờ tính chất này mà baking soda được dùng để làm bánh nở xốp.
Phương trình phản ứng hóa học: NaHCO₃ + HCl → NaCl + H₂O + CO₂↑
Trong phản ứng này, ion HCO₃⁻ nhận proton H+ từ HCl tạo thành H2CO3. Đây là axit yếu nên tiếp tục bị phân hủy thành H2O và CO2.
5.2 NaHCO3 phản ứng với Bazơ mạnh
NaHCO3 cũng có tính axit yếu, có thể tác dụng với các bazơ mạnh (NaOH, KOH) để tạo thành muối và nước. Khi phản ứng với bazơ, hợp chất này sẽ nhường proton để tạo thành ion CO₃²⁻.
Phương trình phản ứng hóa học: NaHCO₃ + NaOH → Na₂CO₃ + H₂O.
Từ những chia sẻ trên đây ta có thể tổng kết được câu trả lời cho câu hỏi “NaHCO3 có tính lưỡng tính không”
NaHCO3 là chất lưỡng tính vì nó có thể:
- Nhận proton từ axit (tính bazơ).
- Nhường proton cho bazơ (tính axit).
Nhờ tính chất này mà baking soda có nhiều ứng dụng như làm bánh, sản xuất thuốc, tẩy rửa nhẹ…
6. Ứng dụng của NaHCO3 trong đời sống hiện nay mà bạn nên biết
NaHCO3 lưỡng tính nên có thể phản ứng linh hoạt với nhiều hợp chất axit và bazơ. Do vậy NaHCO₃ có thể sử dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ thực phẩm, dược phẩm cho đến xử lý nước. Dưới đây là 6 ứng dụng phổ biến nhất của natri bicarbonat:
6.1 Ứng dụng của NaHCO3 trong xử lý nước hồ bơi
NaHCO3 (baking soda) có tính kiềm tự nhiên với độ pH bằng 8. Do vậy, chất này được sử dụng để tăng độ pH và độ kiềm cho nước hồ bơi. Ngoài baking soda, Na2CO3 (soda ash light) cũng có tác dụng làm tăng pH nước. Tuy nhiên NaHCO3 chỉ làm tăng nhẹ độ kiềm mà không làm tăng pH quá nhiều.
Một số công dụng của NaHCO3 trong xử lý nước hồ bơi như sau:
- Hỗ trợ xử lý tảo: Khi châm clo vào nước để diệt tảo, nó sẽ làm giảm pH nước. Để tối ưu hóa hiệu quả của hóa chất clo, cần sử dụng baking soda để kéo pH về khoảng cân bằng (7.2 – 7.6).
- Giảm ăn mòn hồ bơi: Khi độ kiềm trong bể bơi quá thấp, lớp lót hoặc gạch sẽ ăn mòn. Lúc này cần châm thêm baking soda để tăng kiềm.
- Điều chỉnh độ pH: Khi sử dụng axit HCl để giảm pH, nếu cho quá liều lượng thì phải châm thêm NaHCO3 để cân bằng lại pH.

6.2 NaHCO3 dùng trong sản xuất thủy tinh
NaHCO3 khi phân hủy sẽ tạo thành Na2CO3 (soda ash) – một nguyên liệu quan trọng trong ngành sản xuất thủy tinh. Soda giúp làm giảm nhiệt độ nóng chảy của silicat (cát silic), giúp rút ngắn thời gian sản xuất và tiết kiệm chi phí năng lượng. Về lý thuyết, có thể dùng baking soda làm tiền chất tạo ra soda ash, tuy nhiên trên thực tế người ta vẫn ưu tiên dùng trực tiếp Na2CO3.
Bạn có biết tại sao NaHCO3 không được sử dụng phổ biến để sản xuất thủy tinh? Nguyên nhân là vì năng lượng và thời gian cần thiết để phân hủy NaHCO3 thành Na2CO3 cao hơn so với sử dụng trực tiếp soda. Dùng soda ash giúp tiết kiệm chi phí và nâng cao hiệu suất sản xuất.
Xem thêm: Phương trình nhiệt phân NaHCO3 và những điều cần biết
6.3 NaHCO3 là phụ gia dùng trong chế biến thực phẩm
NaHCO3 (baking soda) được sử dụng rộng rãi trong ngành thực phẩm, thường được gọi muối nở, thuốc muối. Đây là một phụ gia thực phẩm an toàn, được phép sử dụng theo tiêu chuẩn quốc tế. Baking soda được Ủy ban Tiêu chuẩn Thực phẩm quốc tế Codex đặt mã INS500. Còn trong hệ thống phụ gia thực phẩm châu Âu thì có mã E500(II).
Dưới đây là một số ứng dụng của NaHCO3 trong chế biến thực phẩm:
- Làm các loại bánh xốp như bánh quy, bánh mì nướng…
- Trung hòa axit, giảm độ chua trong thực phẩm
- Làm mềm thịt, đậu, rau củ
- Tăng độ giòn và giúp thực phẩm giữ màu tốt hơn
- Khử mùi, rửa rau củ, khử mùi tanh của thịt cá
6.4 NaHCO3 dùng tạo gas trong các loại nước ngọt
Phương trình minh chứng cho câu giải đáp NaHCO3 có lưỡng tính không cho thấy NaHCO3 khi phản ứng với axit sẽ sinh ra bọt khí CO2. Nhờ tính chất này, baking soda được sử dụng để tạo khí gas cho các sản phẩm nước giải khát có gas. Nước ngọt có bọt sủi khi khui nắp không chỉ làm tăng cảm giác sảng khoái, mà còn giúp làm tăng hương vị.

6.5 NaHCO3 dùng làm thành phần trong thuốc trị đau dạ dày
NaHCO₃ (natri bicarbonat) là thành phần quan trọng trong các loại thuốc đau dạ dày. Vì trong dạ dày có chứa axit HCl, NaHCO3 có tính bazơ nhẹ nên có tác dụng trung hòa và ức chế tiết acid. Các loại thuốc trị đau dạ dày có chứa natri bicarbonat thường có vị mặn, dạng viên hoặc bột.
Dưới đây là một số công dụng của NaHCO3 trong thuốc trị đau dạ dày là:
- Giảm nhanh lượng axit HCl dư thừa trong dạ dày.
- Giảm cảm giác nóng rát, đau tức vùng thượng vị.
- Hỗ trợ làm dịu cơn đau do viêm loét hoặc rối loạn tiêu hóa.
6.6 Một vài công dụng khác của baking soda mà bạn nên biết
Ngoài những công dụng trong thực phẩm, dược phẩm và xử lý nước, NaHCO3 (baking soda) còn được dùng trong nhiều lĩnh vực khác. Dưới đây là những ứng dụng của baking soda được nhiều người biết đến:
- Baking soda trong kem đánh răng giúp làm trắng răng.
- Bột baking soda giảm mùi hôi nách, khử mùi hôi chân, khử mùi hôi giày.
- Trộn bột baking soda với nước để tẩy tế bào chết.
- Baking soda làm chất tẩy rửa trong nhà tắm, nhà vệ sinh, làm sạch vết ố trên thảm, trên quần áo, đánh bóng xoong nồi…
7. Câu hỏi thường gặp
Bên cạnh giải đáp thắc mắc NaHCO3 có lưỡng tính không, Lifevista còn trả lời một số câu hỏi thường gặp về baking soda.
7.1 Vì sao NaHCO3 được gọi là muối axit?
NaHCO₃ được gọi là muối axit vì nó là sản phẩm trung hòa một phần của axit cacbonic (H₂CO₃). Phân tử vẫn còn giữ lại một nguyên tử hydro có thể phản ứng, do vậy nó có tính axit yếu. Tuy nhiên, NaHCO3 vẫn có tính bazơ vì có thể tác dụng với axit mạnh hơn (HCl). Tính bazơ của NaHCO3 chiếm ưu thế hơn so với tính axit.
7.2 Có thể dùng baking soda (NaHCO3) trung hòa môi trường axit được hay không?
Có thể. Baking soda (NaHCO₃) là một chất có tính kiềm yếu, nên hoàn toàn có khả năng trung hòa môi trường axit. Nhờ vậy mà baking soda được dùng để trung hòa axit dạ dày, trung hòa độ chua thực phẩm và ổn định pH hồ bơi.
7.3 Na2CO3 và NaHCO3 khác nhau như thế nào?
Na2CO3 và NaHCO3 đều có thể được gọi là soda. Tuy nhiên chúng là hai chất hoàn toàn khác nhau:
- NaHCO₃ là muối axit, có tính kiềm nhẹ (pH khoảng 8), thường được dùng trong thực phẩm, thuốc trị đau dạ dày và xử lý nước nhẹ.
- Na₂CO₃ là muối trung hòa, có tính kiềm mạnh hơn (pH ~11), thường dùng trong công nghiệp như sản xuất thủy tinh, bột giặt và xử lý nước thải.
- NaHCO₃ dễ bị phân hủy sinh khí ở nhiệt độ cao, còn Na₂CO₃ thì ổn định hơn.

7.5 NaHCO3 là muối axit hay bazơ?
NaHCO3 có lưỡng tính không? Là muối axit hay muối bazơ? NaHCO₃ là muối axit, không phải muối bazơ. NaHCO₃ được tạo thành khi axit H₂CO₃ bị trung hòa một phần bởi NaOH. Vì chỉ có một H⁺ bị thay thế, phân tử NaHCO₃ vẫn còn một ion H+ có tính axit.
7.6 Natri bicarbonate có tính ăn da không?
NaHCO₃ không có tính ăn da mạnh như axit hay bazơ mạnh. Tuy nhiên, tiếp xúc lâu dài có thể gây kích ứng nhẹ cho da nhạy cảm. Khi sử dụng với lượng lớn nên mang găng tay bảo hộ.
7.8 Sodium bicarbonate có phải là một bazơ không?
Sodium bicarbonate (NaHCO3 hay baking soda) là một bazơ yếu vì nó có độ pH > 7. Khi hòa tan vào nước nó có pH khoảng 8.3. Với độ kiềm này, baking soda có thể trung hòa được axit.
8. Kết luận
Bài viết trên đây đã giải đáp thắc mắc NaHCO3 có lưỡng tính không. Bên cạnh đó, Lifevista cũng đã chia sẻ thêm một số ứng dụng dựa trên tính chất của baking soda. Hy vọng với những thông tin trên đây sẽ giúp bạn hiểu hơn về hợp chất này.



